Le changement climatique favorise la propagation de l’encéphalite à tiques et des virus transmis par le moustique tigre
Augmentation de la maladie de Lyme et de l’encéphalite à tiques, transmises par les tiques, de la dengue, du Zika, du chikungunya et de la fièvre jaune, inoculés par des espèces invasives de moustiques : le changement climatique augmente les aires de répartition de ces vecteurs et accélère les cycles viraux de leurs agents pathogènes.

Changement climatique et vecteurs d’agents pathogènes : une alerte très récente
Dans les années 2000, des scientifiques avaient publié un article dans lequel ils prévoyaient l’augmentation de la dengue et du paludisme à cause du réchauffement planétaire. Si ces premiers travaux ont été très discutés, de plus en plus d’éléments apparaissent quant aux effets du changement climatique sur l’expansion de certaines maladies infectieuses, notamment virales. « Cela a toujours été très critiqué car les maladies ne sont pas liées aux seuls facteurs du climat et ses effets indirects sont plus difficiles à détecter que ceux directs. Dans le cinquième rapport du GIEC, les scientifiques sont restés très prudents. Mais le climat joue un rôle en toile de fond », explique Cyril Caminade, chercheur à l’université de Liverpool et à l’Institut des infections et de santé globale. En effet, le dernier rapport du Groupe d’experts intergouvernemental sur l’évolution du climat (GIEC), en 2014, ne notait pas d’incidences négatives du changement climatique sur les maladies à vecteurs, indiquant seulement que « les variations locales de la température et des précipitations ont modifié la répartition de certaines maladies d’origine hydrique et de certains vecteurs de maladies » [a].
En avril 2015, une dizaine d’articles, regroupés dans un numéro spécial du journal académique « Philosophical transactions » [1] de la Royal Society, section Sciences biologiques, liste sept vecteurs d’agents pathogènes qui pourraient être impactés par le changement climatique. Les observations de terrain viennent confirmer les modélisations.
Le moustique tigre ne cesse de se propager
D’ici 2050, 2,4 milliards d’individus devraient être exposés au moustique tigre, vecteur de plus de 20 virus dangereux, dont le Zika et le chikungunya et ceux provoquant dengue et fièvre jaune.
L’un des éléments préoccupants pour la question des maladies est la diffusion du moustique tigre, Aedes albopictus, qui pique en priorité l’être humain et peut lui transmettre, ainsi qu’aux animaux domestiques, plus de 20 virus dangereux [[2], page 2] dont ceux de la dengue [b], du chikungunya [c], du Zika [d] et de la fièvre jaune [e]. Cette espèce possède deux formes, toutes deux d’origine asiatique, une adaptée au climat tropical et une deuxième aux climats tempérés. C’est cette deuxième forme qui se répand en Europe.
« Il y a 5-6 ans, nous disions que le moustique tigre allait se propager, sans bien savoir dans quelles limites. Aujourd’hui, il s’est répandu un peu partout », note Cyril Caminade. « Il existait des prévisions pour 2020. Mais on ne pensait pas qu’il allait atteindre Paris si vite. Il y est arrivé il y a trois ans et s’est installé vraiment en 2016 », rapporte Anna-Bella Failloux, directrice de recherche en virologie à l’institut Pasteur.
Le réseau de surveillance européen MediLabSecure [I] a été mis en place en 2014 pour observer l’évolution des virus dans les pays qui bordent la mer Méditerranée et la mer Noire. Le Centre européen de prévention des maladies (ECDC), créé en 2005, établit chaque année des cartes de la distribution des vecteurs pathogènes tels que les moustiques du genre Aedes [II] [3].
Au moustique tigre, s’ajoutent les deux autres espèces du même genre : Aedes japonicus et Aedes aegypti, qui se propagent aussi. « Aedes aegypti a été éradiqué en Europe au début du siècle dernier, mais on l’a vu se réinstaller en Turquie en 2015 et sur le pourtour de la mer Noire dans les années 2000. Tandis que Aedes japonicus envahit l’Europe », indique Anna-Bella Failloux.
En France, la carte de surveillance du moustique tigre montre une progression continue de son aire de répartition depuis 2004 d’après Santé publique France – InVS [f] avec une accélération en 2017 d’après celle d’avril de l’European Centre for Disease Prevention and Control ([g] et voir illustrations ci-dessous et la suivante, celle de gauche, «Distribution actuelle du moustique tigre en Europe… »).
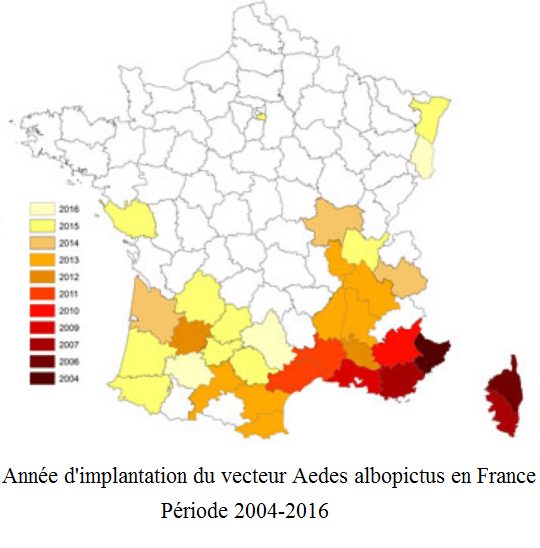
Source : Santé publique France – InVS, 24/07/2017
Or le changement climatique peut influencer la transmission des maladies à vecteurs en modifiant les aires de répartition des espèces d’insectes, celle du moustique-tigre en particulier [[2], page 1].
Dengue, fièvre jaune, Zika et chikungunya : épidémies au Brésil …
Pour Zika, comme pour la dengue, on se rend compte que les épidémies ont tendance à suivre le phénomène El niño en Amérique latine. L’équipe de Cyril Caminade a publié en 2017 dans PNAS un article montrant que l’année 2015 a été, depuis 1950, la plus importante en Amérique du Sud en terme d’infection par le virus Zika [4]. « En 2015, il y a eu un El niño dit godzilla, un super-niño. Au Brésil, cela a entrainé des températures chaudes, des pluies importantes puis des sécheresses terribles. Ce sont des conditions favorables au développement des moustiques. D’autant que les personnes dans les milieux les plus pauvres ont l’habitude d’avoir des bidons pour stocker l’eau, où les moustiques peuvent se développer », détaille Cyril Caminade.
Pour compliquer la chose, le moustique peut porter plusieurs virus en même temps. « Dans les zones tropicales, on peut avoir une multiplication des problèmes, précise Anna-Bella Failloux. Avec le Zika et le chikungunya, qui ne sont d’ailleurs pas originaires d’Amérique du Sud, le Brésil connaît aujourd’hui une forte co-circulation de virus, qui s’ajoutent à ceux arrivés plus anciennement, comme la dengue et la fièvre jaune ». Au Brésil, l’épidémie de fièvre jaune la plus importante depuis 1960 selon l’OMS [e] se propage depuis décembre 2016 et, si le nombre d’individus infectés par Zika a grandement diminué en 2017 par rapport à 2016, de nouvelles épidémies de cette infection sont à prévoir au Brésil, selon un rapport publié le 12 juillet 2017 par l’ONG Human Right Watch [d].
A l’origine de cette quadruple épidémie – dengue, Zika, chikungunya et fièvre jaune – qui frappe le Brésil tour à tour depuis 2015 : les moustiques Aedes aegypti et Aedes albopictus (moustique tigre) [b].
…et cas importés en France
D’après la surveillance épidémiologique de Santé publique France – InVS [h], en 2016, 184 cas de dengue, 781 de Zika et 34 de chikungunya, ont été observés en France métropolitaine, tous importés, à l’exception de 12 cas autochtones d’infection à virus Zika par transmission sexuelle.
« Concernant la prévention, ce n’est pas le moustique qui importe la maladie, mais nous. Je peux partir à Bangkok en voyage et revenir avec la dengue. J’importe donc la maladie sur un territoire où le vecteur est déjà présent. Donc, dans un premier temps, il faut se vacciner, lorsque le vaccin existe, comme pour la fièvre jaune par exemple. Une fois que l’on a contracté la maladie, il n’y a pas de médicament spécifique qui fonctionne. Le seul moyen de se protéger est alors de lutter contre le moustique : ne pas laisser des points d’eau stagnante par exemple ou utiliser des moustiquaires. Et, en période épidémique, il faut tuer le moustique par des insecticides. Mais il a développé des résistances et nous sommes dans une situation critique où ils ne sont plus efficaces à 100 %. Cela oblige à chercher des alternatives, comme la lutte biologique par les prédateurs naturels du moustique, par exemple les libellules ou certains poissons, en les installant dans les gîtes larvaires. » Dr Anna-Bella FAILLOUX
Au XXIè siècle, le moustique tigre va se propager vers le nord et en altitude
Différentes études concluent à la modification des habitats des vecteurs de la malaria au Népal et des moustiques dans les montagnes du Kenya [5] [6] [7].
« Les vecteurs tropicaux, aidés par la mondialisation, vont pouvoir mieux se développer vers le nord. Tout va se décaler », résume Cyril Caminade.
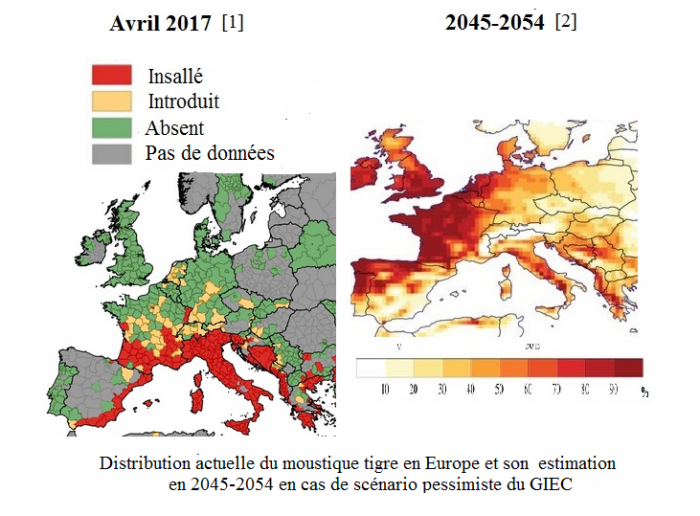
Sources : [1] European Centre for Disease Prevention and Control, avril 2017
[2] [Proestos Y et al, 2015]
Selon un article paru en 2015, d’ici 2050, 2,4 milliards d’individus devraient être exposés au moustique tigre. Son aire de répartition évoluerait cependant beaucoup. Certaines zones lui seraient extrêmement propices, comme la France, l’Irlande, le sud de la Grande-Bretagne, le nord-ouest de la péninsule Ibérique, l’est des Etats-Unis et de la Chine, contrairement à d’autres où les conditions de température seraient trop chaudes et sèches en été comme l’extrême sud de l’Europe, l’Afrique centrale, Madagascar, l’Asie du sud ou le nord de l’Amérique du Sud. [[2], pages 1 et 9] [8] [9]. En effet, il faut le cumul des conditions de hautes températures et d’humidité pour son bon développement. Un climat trop chaud et sec entraînera la mort du moustique.
Le réchauffement accélère le métabolisme viral infectant des vecteurs
Le changement climatique a aussi une influence sur le développement interne des moustiques. « L’augmentation de température va accélérer le métabolisme des moustiques et donc des virus dont ils sont les hôtes. Avec une augmentation de 10°C, on observe une multiplication par 10 de l’accélération du cycle », note Anna-Bella Failloux. Alors que la période d’incubation de la dengue est d’environ 3 semaines, elle peut descendre à moins de 2 semaines, voire à 5 jours avec des températures de 30°C. De même, la fréquence des morsures augmente avec une température plus importante. Selon un des articles que la chercheuse a publié, la transmission du chikungunya nécessite la combinaison des trois facteurs : la population de moustiques, le type de virus (la souche virale) et la température. Les conditions de température influent sur l’adaptation des souches virales et donc sur leur capacité d’infection [10]. Le contexte environnemental rend donc plus complexe l’évolution des maladies vectorielles.
Le changement climatique accroît le risque d’extension du chikungunya
Ainsi, un article paru en 2013 montre que le changement climatique augmentera la période de risque de transmission du chikungunya à plus de quatre mois par an d’ici 2100 dans le sud de la France, le nord de l’Italie, le nord-ouest de la péninsule Ibérique et le sud de l’Europe du Centre [Fischer et al., 2013] [11].
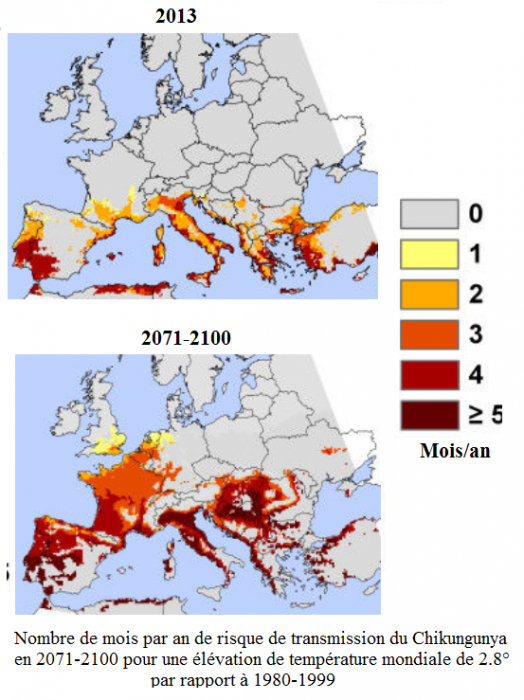
Source : Fischer et al., 2013
Le changement climatique augmente le risque de propagation de la maladie de Lyme et de l’encéphalite à tiques transmises par les tiques
Dans le nord de la Russie d’Europe, les cas d’encéphalite virale à tiques ont augmenté de 50 fois, le changement climatique y contribuant largement, et au Canada, ceux de maladie de Lyme de 2 à 5 fois, pour laquelle 27 000 cas par an sont recensés en France, répartis dans toutes les régions.
Si toutes ces maladies sont liées aux moustiques, d’autres vecteurs [i] existent, comme les tiques [III]. « Le nombre de cas de maladies liées aux tiques a augmenté en Russie et au Canada, atteste Cyril Caminade. En Russie le phénomène a augmenté d’un facteur 3 à 4 entre 1970 et aujourd’hui et surtout sur les 10 dernières années ». Ainsi, dans le nord de la Russie d’Europe, entre 1980-1989 et 2002-2011, les cas d’encéphalite virale à tiques (ou méningo-encéphalite verno-estivale) [j] ont augmenté de 50 fois, le changement climatique y contribuant de manière importante [12]. Son émergence en Europe centrale et de l’Est, notamment depuis 1990, a aussi été attribuée au changement climatique [13].
Une étude parue en 2014 estime que le changement climatique serait en partie à l’origine de l’émergence de la maladie bactérienne de Lyme (ou borréliose) [k], issue des tiques, dans le nord-est de l’Amérique du Nord et y favoriserait fortement sa propagation à l’avenir. L’élévation de la température a augmenté le taux de reproduction des tiques vecteurs de la maladie de Lyme de 2 à 5 fois au Canada et de 1.5 à 2 fois aux Etats-Unis [14].
L’Europe est également frappée : ainsi, en France, pour la période allant de 2009 à 2011, l’estimation annuelle de l’incidence nationale de la borréliose de Lyme était en moyenne de 43 cas/100 000 (27 000 cas par an) [l, page 20] [IV], répartis dans toutes les régions [V] . Ceci alors que son protocole diagnostique et thérapeutique est toujours mal appliqué, le diagnostic étant uniquement clinique (érythème migrant) au stade primaire, de nombreux médecins demandant une sérologie, le plus souvent négative à ce stade, retardant la prescription d’un antibiotique pourtant urgent, selon le professeur Christian Perronne, chef de service en infectiologie ([15], [m], [n], [VI], [VII] et [VIII]) .
Nick Ogden met à nouveau en avant, dans une étude parue en 2016, le fait que le réchauffement climatique impacte le cycle de vie de ces arthropodes que sont les tiques [16]. Un article paru en 2017 conclut que, en cas de scénario pessimiste du GIEC (RCP 8.5), la prolifération de la tique atteindra la côte nord canadienne, et que même si les engagements de rester sous la barre des 2°C sont tenus (scénario RCP 2.5), la maladie de Lyme continuera de progresser au Canada, depuis son émergence autour de 2004 [17].
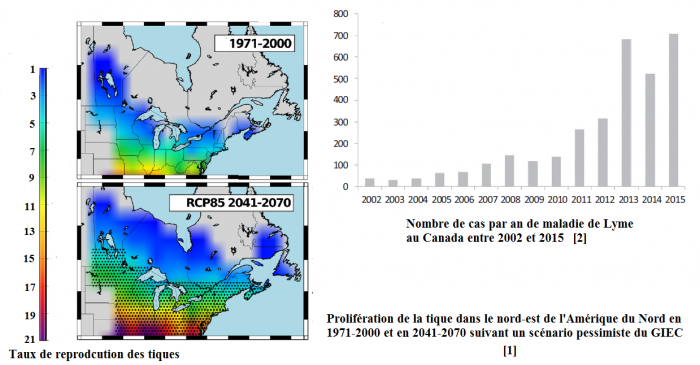
Sources : [1] McPherson et al., 2017
[2] Ogden et al., 2016
Les maladies parasitaires également concernées
Des questions se posent quant à l’évolution des maladies liées à des vers. Depuis l’apparition de cas de bilharziose en Corse en 2011, un programme a été lancé pour étudier cette arrivée dans des régions où elle n’avait jamais été détectée [18]. Aussi appelée schistosomiase, cette maladie est due au ver Schistosoma haematobium, présent jusque-là uniquement en Afrique. Ces œufs éclosent en milieu aqueux puis la larve s’implante dans des escargots d’eau douce avant de contaminer des hommes qui y sont présents. Les eaux Corse auraient été infestées une première fois et le ver aurait parasité un escargot local.
Le changement climatique pourrait aussi avoir des effets sur la douve du foie, Fasciola hepatica, un parasite des moutons qui peut se transmettre aux hommes. « On observe de plus en plus de cas cliniques de douve du foie chez les moutons au Royaume-Uni », indique Cyril Caminade. Selon l’article de synthèse de Utaaker et Roberston en 2014, l’élévation des températures pourrait augmenter l’aire de répartition d’un escargot, un hôte intermédiaire, et aussi l’efficacité du parasite même. En revanche, une réduction des pluies affecterait négativement le parasite. La complexité de ces transmissions liées à différents hôtes nécessite des études plus approfondies pour comprendre les effets du facteur qu’est le changement climatique [19].
L’activité humaine aggrave l’expansion des maladies…
Face à l’ensemble de ces maladies, si le climat a une importance notable, nos activités jouent plus directement un rôle. Pour les virus transportés par les moustiques, « le facteur premier de diffusion est l’introduction de l’espèce quelque part. S’il n’y avait pas de globalisation, d’échanges dans le monde entier, il n’y aurait évidemment pas ces problèmes. Nous vivons aussi plus en ville et les moustiques s’adaptent à ces milieux », explique Cyril Caminade. « Nous utilisons des contenants artificiels (pots de fleurs, bacs qui retiennent l’eau, gouttières, bidons qui se remplissent, poubelles etc.) qui permettent aux moustiques de pondre leurs œufs en milieu humide favorable à leur développement, et nous, les hôtes, nous bougeons » ! « On a remarqué par exemple que l’on pouvait suivre la propagation des moustiques le long des autoroutes », précise Anna-Bella Failloux.
…la diminution des services publics sanitaires également
Dans une étude sur l’émergence du chikungunya en Europe, les chercheuses Fadila Amraoui et Anna-Bella Failloux estiment qu’au-delà du réchauffement climatique qui contribue à augmenter l’aire de distribution des moustiques, la diminution des services publics chargés de les contrôler auront des effets importants sur la santé humaine [20].
Au Brésil, la survie et la propagation des moustiques du genre Aedes sont amplifiées par les conditions d’accès à l’eau. Un réseau mal entretenu entraine des fuites ou des eaux stagnantes tandis qu’en son absence, la population utilise des contenants pour la conserver. Sans leur protection, les moustiques les utilisent pour pondre et se reproduire. L’ONG Human Right Watch conclut que, sans une prise en charge de l’assainissement et sans communication auprès des habitants, les épidémies ne peuvent que se poursuivre, voire s’aggraver.
Références (revues scientifiques à comité de lecture)
[1] Theme issue compiled and edited by Paul E. Parham, Joanna Waldock, George K. Christophides and Edwin Michael ‘Climate change and vector-borne diseases of humans’, Philosophical transactions of the Royal Society, biological sciences, 05 April 2015; volume 370, issue 1665
http://rstb.royalsocietypublishing.org/content/370/1665
[2] Proestos Y, Christophides GK, Ergüler K, Tanarhte M, Waldock J, Lelieveld J. 2015 Present and future projections of habitat suitability of the Asian tiger mosquito, a vector of viral pathogens, from global climate simulation. Phil. Trans. R. Soc. B 370: 20130554.
http://dx.doi.org/10.1098/rstb.2013.0554
http://rstb.royalsocietypublishing.org/content/370/1665/20130554
http://rstb.royalsocietypublishing.org/content/370/1665/20130554.figures-only
[3] Anna-Bella Failloux, Ali Bouattour, Chafika Faraj, Filiz Gunay, Nabil Haddad, Zoubir Harrat, Elizabeta Jancheska, Khalil Kanani, Mohamed Amin Kenawy, Majlinda Kota, Igor Pajovic, Lusine Paronyan, Dusan Petric, Mhammed Sarih, Samir Sawalha, Taher Shaibi, Kurtesh Sherifi, Tatiana Sulesco, Enkelejda Velo, Lobna Gaayeb, Kathleen Victoir, Vincent Robert. 2017. Surveillance of Arthropod-Borne Viruses and Their Vectors in the Mediterranean and Black Sea Regions Within the MediLabSecure Network. Curr Trop Med Rep March 2017, Volume 4, Issue 1, pp 27–39. DOI 10.1007/s40475-017-0101-y
https://link.springer.com/article/10.1007/s40475-017-0101-y
[4] Caminade C., Turner J., Metelmann S, Hesson J.C., Blagrove M. S. C., Solomon T., Morse A. M., and Baylisa M., 2017. Global risk model for vector-borne transmission of Zika virus reveals the role of El Niño 2015. PNAS | January 3, 2017 | vol. 114 | no. 1 | 119–124
http://www.pnas.org/content/114/1/119.abstract
[5] Dhimal, M., B. Ahrens, and U. Kuch, Species composition, seasonal occurrence, habitat preference and altitudinal distribution of malaria and other disease vectors in eastern Nepal. Parasit Vectors, 2014. 7(1): p. 540
https://parasitesandvectors.biomedcentral.com/articles/10.1186/s13071-014-0540-4
[6] Dhimal M., Bodo Ahrens, Kuch U., Altitudinal shift of malaria vectors and malaria elimination in Nepal. Malaria Journal, 2014. 13(1): p. P26.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4179318/
[7] Kweka, E.J., et al., A first report of Anopheles funestus sibling species in western Kenya highlands. Acta Trop, 2013. 128(1): p. 158-61
https://www.ncbi.nlm.nih.gov/pubmed/23792011
[8] Caminade C, Medlock JM, Ducheyne E, Marie McIntyre K, Leach S, Baylis M, Morse AP. 2012 Suitability of European climate for the Asian tiger mosquito Aedes albopictus: recent trends and future scenarios. J. R. Soc. Interface 9, 2708–2717. (doi:10.1098/rsif.2012.0138)
[9] Fischer D, Thomas SM, Neteler M, Tjaden NB, Beierkuhnlein C 2014 Climatic suitability of aedes albopictus in europe referring to climate change projections: Comparison of mechanistic and correlative niche modelling approaches Euro Surveillance (Bulletin Europeen Sur Les Maladies Transmissibles; European Communicable Disease Bulletin). 19 (6): 20696
https://tools.niehs.nih.gov/cchhl/index.cfm/download/pdf/referenceids/9124
[10] Zouache K, Fontaine A, Vega-Rua A, Mousson L, Thiberge J-M, Lourenco-De-Oliveira R, Caro V, Lambrechts L, Failloux A-B. 2014 Three-way interactions between mosquito population, viral strain and temperature underlying chikungunya virus transmission potential. Proc. R. Soc. B 281: 20141078.
http://dx.doi.org/10.1098/rspb.2014.1078
[11] Fischer D, Thomas SM, Suk JE, Sudre B, Hess A, Tjaden NB, Beierkuhnlein C, Semenza JC. 2013 Climate change effects on chikungunya transmission in Europe: geospatial analysis of vectors climatic suitability and virus temperature requirements. Int.J. Health Geogr. 12, 51. (doi:10.1186/1476-072X-12-51)
https://ij-healthgeographics.biomedcentral.com/articles/10.1186/1476-072X-12-51
[12] Nikolay K. Tokarevich, Andrey A. Tronin, Olga V. Blinova, Roman V. Buzinov, Vitaliy P. Boltenkov, Elena D. Yurasova & Jo Nurse (2011) The impact of climate change on the expansion of Ixodes persulcatus habitat and the incidence of tick-borne encephalitis in the north of European Russia, Global Health Action, 4:1, 8448, DOI: 10.3402/gha.v4i0.8448
http://journals.co-action.net/index.php/gha/article/view/8448
[13] Martin Lukan,corresponding author Eva Bullova, and Branislav Petko 2010 Climate Warming and Tick-borne Encephalitis, Slovakia Emerg Infect Dis. 2010 Mar; 16(3): 524–526.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3321998/
[14] Ogden NH, Radojević M, Wu X, Duvvuri VR, Leighton PA, Wu J. 2014. Estimated effects of projected climate change on the basic reproductive number of the Lyme disease vector Ixodes scapularis. Environ Health Perspect 122:631–638;
http://dx.doi.org/10.1289/ehp.1307799
[15] Gary P. Wormser et al. 2006, The Clinical Assessment, Treatment, and Prevention of Lyme Disease, Human Granulocytic Anaplasmosis, and Babesiosis: Clinical Practice Guidelines by the Infectious Diseases Society of America Clinical Infectious Diseases 2006; 43:1089–134
http://cid.oxfordjournals.org/content/43/9/1089.full.pdf+html
[16] Ogden N.H., Lindsay L.R. 2016. Effects of Climate and Climate Change on Vectors and Vector-Borne Diseases : Ticks Are Different. Trends in Parasitology, Volume 32 , Issue 8 , 646 – 656
http://dx.doi.org/10.1016/j.pt.2016.04.015
[17] Michelle McPherson, Almudena García-García, Francisco JoséCuesta-Valero, Hugo Beltrami, Patti Hansen-Ketchum, Donna MacDougall, and Nicholas Hume Ogden. 2017. Expansion of the Lyme Disease Vector Ixodes Scapularis in Canada Inferred from CMIP5 Climate Projections. Environmental Health Perspectives.
[18] Boissier, Jérôme Hélène Moné, Guillaume Mitta, M Dolores Bargues, David Molyneux, Santiago Mas-Coma. 2015. Schistosomiasis reaches Europe. The Lancet Infectious Diseases , Volume 15 , Issue 7 , 757 – 758
http://www.thelancet.com/journals/laninf/article/PIIS1473-3099(15)00084-5/abstract
[19] Kjersti Selstad Utaaker et Lucy J. Roberston, 2014. Climate change and foodborne transmission of parasites: A consideration of possible interactions and impacts for selected parasites. Food Research International,
http://dx.doi.org/10.1016/j.foodres.2014.06.051
[20] Amraoui F., Failloux A.-B. 2016. Chikungunya: an unexpected emergence in Europe. Current Opinion in Virology 2016, 21:146–150.
Notes
[a] Résumé à l’intention des décideurs, p 6, GIEC, 5è rapport, Groupe de travail II « Incidences, adaptation et vulnérabilité », 2014
http://www.ipcc.ch/pdf/assessment-report/ar5/wg2/ar5_wgII_spm_fr.pdf
http://www.ipcc.ch/report/ar5/wg2/index_fr.shtml
[b] Prévoir les flambées de dengue en fonction du climat juillet 2012 IRD
Dengue et dengue sévère – Aide-mémoire N°117 OMS Avril 2017
http://www.who.int/mediacentre/factsheets/fs117/fr/
Lutte contre la dengue – Le moustique – OMS
http://www.who.int/denguecontrol/mosquito/fr/
[c] Chikungunya : le rôle clé de l’«immunité innée» décembre 2010 IRD
[d] Brésil : L’épidémie de Zika met en évidence les insuffisances sur le plan des droits humains Human Rights Watch 12 juillet 2017
Le virus zika : la nouvelle menace du moustique tigre mai 2014 IRD
[e] Fièvre jaune – Brésil Bulletin d’information sur les flambées épidémiques OMS 4 avril 2017
http://www.who.int/csr/don/04-april-2017-yellow-fever-brazil/fr/
Epidémie historique de fièvre jaune au Brésil LE MONDE | 16.02.2017 Claire Gatinois
Aide-mémoire Fièvre jaune OMS 2014
http://apps.who.int/iris/bitstream/10665/204190/1/Fact_Sheet_WHD_2014_FR_15261.pdf
Fièvre jaune : informations et traitements – Institut Pasteur
https://www.pasteur.fr/fr/centre-medical/fiches-maladies/fievre-jaune
[f] Chikungunya, dengue et zika – Données de la surveillance renforcée en France métropolitaine en 2017, Santé publique France – InVS, 24/07/2017
Chikungunya – dengue – Zika : informations et traitements – Institut Pasteur
https://www.pasteur.fr/fr/centre-medical/fiches-maladies/chikungunya
https://www.pasteur.fr/fr/centre-medical/fiches-maladies/dengue
https://www.pasteur.fr/fr/centre-medical/fiches-maladies/zika
[g] Aedes albopictus – current known distribution in Europe, April 2017 European Centre for Disease Prevention and Control.22 May 2017
[h] Surveillance du chikungunya, de la dengue et des infections à virus Zika en France métropolitaine, 2016, Santé publique France – InVS, BEH 12, 30 mai 2017
http://invs.santepubliquefrance.fr/beh/2017/12/2017_12_2.html
http://invs.santepubliquefrance.fr/beh/2017/12/pdf/2017_12_2.pdf
[i] Maladies à transmission vectorielle Aide-mémoire N°387 Février 2016 OMS
http://www.who.int/mediacentre/factsheets/fs387/fr/
[j] Neuroborréliose, méningo-encéphalite verno-estivale et neurosyphilis Revue médicale suisse 2013
[k] Borréliose / Maladie de Lyme – Office fédéral (suisse) de la santé publique 04.04.2017
[l] Borréliose de Lyme, rapport du groupe de travail, 28 mars 2014 – Haut Conseil de la santé publique
http://www.solidarites-sante.gouv.fr/IMG/pdf/hcspr20140328_borrelioselyme.pdf
[m] Pour les professionnels de la santé : maladie de Lyme – Gouvernement du Canada
[n] Le casse-tête diagnostique de la maladie de Lyme Medscape 5 octobre 2011
http://francais.medscape.com/voirarticle/3290385
Lyme : quand demander une sérologie ? Dr Isabelle Hoppenot Entretiens de Bichat. D’après la communication du Dr Christian Perronne Le Quotidien du Médecin du 12/12/2011
Cartes, infographies, brochures et sites d’information
[I] MediLabSecure
http://medilabsecure.com/resources_factsheets.html
[II] Carte du moustique-tigre en Europe
Autres cartes pour d’autres espèces de moustiques
https://ecdc.europa.eu/en/disease-vectors/surveillance-and-disease-data/mosquito-maps
Cartes pour tous vecteurs
https://ecdc.europa.eu/en/disease-vectors
[III] Infographie : maladies transmises par les tiques
https://ecdc.europa.eu/en/publications-data/small-bites-big-problems-tick-borne-diseases-europe
Brochure : Les conseils de Prudence – la tactique anti-tiques
http://social-sante.gouv.fr/IMG/pdf/tiques_brochure.pdf
[IV] Dépliant et informations : maladie de Lyme
http://social-sante.gouv.fr/IMG/pdf/maladie_de_lyme_depliant_gp.pdf
http://solidarites-sante.gouv.fr/soins-et-maladies/maladies/maladies-infectieuses/maladie-de-lyme
[V] TiquesFrance : Cartographier les morsures sur le territoire français
https://sites.google.com/site/tiquesfrance/#TOC-Carte-interactive-
Maladie de Lyme : la carte de France de présence de tiques
[VI] Western blot Wikipedia
https://fr.wikipedia.org/wiki/Western_blot
[VII] Informations sur la consultation du Pr Christian Perronne – Maladies infectieuses, parasitaires et tropicales (maladie de lyme et maladies associées) AP-HP Groupe hospitalier : Hôpitaux Universitaires Paris Ile-de-France Ouest
http://www.aphp.fr/offre-de-soin/consultation-22850
[VIII] Piqûre de tique, maladie de Lyme : On vous dit tout ! Dispositif-Sante.com
-
-
-
-
Suivez les actualités du réseau
Abonnez-vous à la newsletter du Réseau Action Climat.